 请输入或粘贴题目内容
搜题
请输入或粘贴题目内容
搜题
 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)


在一定温度下,某体积不变的密闭容器中,建立下列化学平衡:C(s)+H2O(g) =CO(g)+H2(g)。下列叙述中不能说明上述可逆反应已达到化学平衡状态的是()
A、体系的压强不再发生变化
B、v正(CO)=v逆(H2O)
C、生成n mol CO的同时生成n mol H2
D、1 mol H—H键断裂的同时断裂2 mol H—O键
 答案
答案
 更多“在一定温度下,某体积不变的密闭容器中,建立下列化学平衡:C(s)+H2O(g) =CO(g)+H2(g)。下列叙述中不能说明上述可逆反应已达……”相关的问题
更多“在一定温度下,某体积不变的密闭容器中,建立下列化学平衡:C(s)+H2O(g) =CO(g)+H2(g)。下列叙述中不能说明上述可逆反应已达……”相关的问题
第1题
A、加压时(体积变小),将使正反应速率增大
B、保持体积不变,加入少许NO2,将使正反应速率减小
C、保持体积不变,加入少许N2O4,再达平衡时,颜色变深
D、保持体积不变,升高温度,再达平衡时颜色变深
第2题
A、若缩小容器的体积,则容器中气体的颜色先变深后又变浅,且比原平衡颜色深
B、若压强不变,向容器中再加入一定量的N2O4,再次达到平衡时各种物质的百分含量不变
C、若体积不变,向容器中再加入一定量的N2O4,相对于原平衡,平衡向正反应方向移动,再次平衡时N2O4的转化率将升高
D、若体积不变,升高温度,再次平衡时体系颜色加深
第3题
A、加压时(容器体积变小),将使正反应速率增大,平衡向逆反应方向移动
B、减小压时(容器体积变大),将使正反应速率增大,平衡向逆反应方向移动
C、保持体积不变,加入红棕色的NO2,正反应速率减小,逆反应速率增大,平衡向逆反应方向移动
D、保持体积不变,加入无色的N2O4,正反应速率增大,平衡向逆反应方向移动
第4题
A、等于5s
B、等于10s
C、大于10s
D、小于10s
第5题
A、平衡向正反应方向移动
B、a>b+c
C、物质B的质量分数增大
D、以上判断都错误
第6题
A、当v(CO)(正)=v(H2)(正),时,反应达到平衡状态
B、其他条件不变,适当增加C(s)的质量会使平衡正向移动
C、保持容器体积不变,充入少量He使体系压强增大,反应速率一定增大
D、其他条件不变,仅将容器的体积缩小一半,再次达到平衡时,H20(g)的平衡浓度可能是原来的2.1倍
第7题
A、x+y
B、平衡向正反应方向移动
C、的体积分数降低
D、B的浓度增大
第8题
A、x+y<z
B、平衡向正反应方向移动
C、的转化率增大
D、的体积分数下降
第9题
A、平衡向逆反应方向移动了
B、物质A的转化率减小了
C、物质B的质量分数增大了
D、a>b
第10题
A、由于气体分子运动的无规则性,所以密闭容器的器壁在各个方向上的压强可能会不相等
B、气体的温度升高时,所有的气体分子的速率都增大
C、气体的分子数越多,气体的压强就越大
D、一定质量一定体积的气体,气体分子的平均动能越大,气体的压强就越大
第11题
氮化镓(GaN)是第三代半导体材料,具有热导率高、化学稳定性好等性质,在光电领域和高频微波器件应用等方面有广阔的前景。
(1)传统的氮化镓制各方法是采用GaC13与NH3在一定条件下反应。NH3的电子式为()。
(2)Johnson等人首次在1100℃下用液态镓与氨气制得氮化镓固体,该可逆反应每生成1molH2放出10.3kJ热量。其热化学方程式为()。
(3)在恒容密闭容器中,加入一定量的液态镓与氨气发生上述反应,测得反应平衡体系中NH3的体积分数与压强(p)、温度(T)的关系如图所示。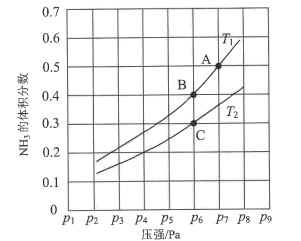 ①下列说法正确的是()(填标号)。
①下列说法正确的是()(填标号)。
a.温度:T1>T2
b.当百分含量ω(NH3)=ω(H2)时,说明该反应处于化学平衡状态
c.A点的反应速率小于C点的反应速率
d.温度恒定为T2,达平衡后再充入氦气(氦气不参与反应),NH3的转化率不变
②既能提高反应速率又能使平衡正向移动的措施有()(写出一条即可)。
③气体分压(p分)=气体总压(p总)×体积分数,用平衡分压代替物质的量浓度也可以表示平衡常数(记作Kp)。在T2时,用含p6的计算式表示C点的()。
(4)如图可表示氮化镓与铜组装成的人工光合系统的工作原理。H+向()(填“左”或“右”)池移动;铜电极上发生反应的电极反应式为()。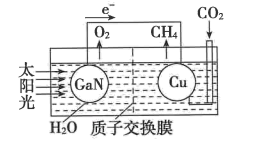








 大学生认证
大学生认证





